Oxirredução: O Que É, Como Ocorre, Tipos, Resumo – Brasil Escola. Já se perguntou como a ferrugem se forma ou como uma bateria funciona? A resposta está na oxirredução, um processo químico fundamental que envolve a transferência de elétrons entre átomos ou moléculas. Neste texto, vamos explorar o conceito de oxirredução, analisando seus mecanismos, tipos e aplicações na biologia, indústria e em diversos outros contextos do nosso dia a dia.
Preparado para mergulhar nesse mundo fascinante de reações químicas?
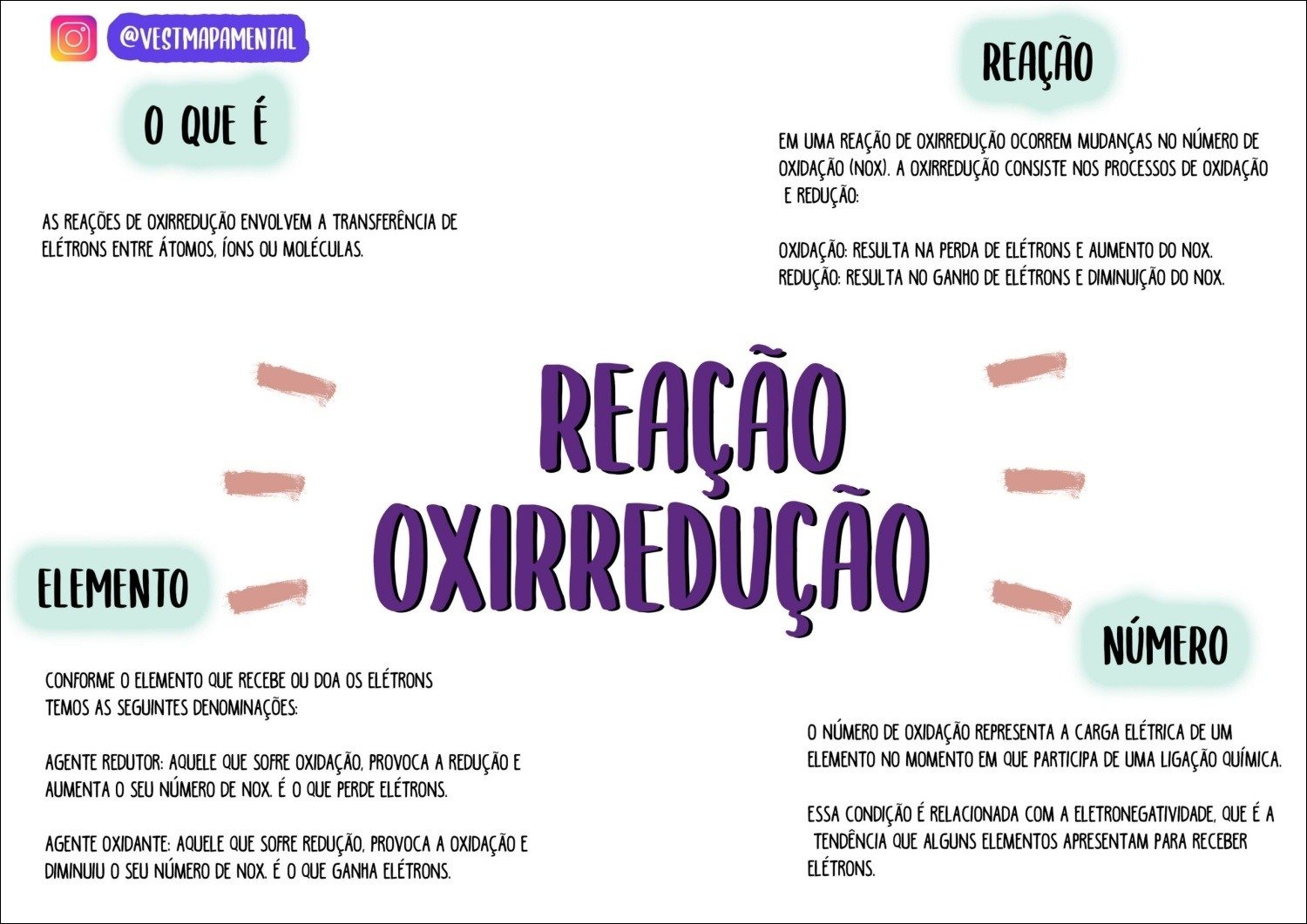
A oxirredução, também conhecida como reação redox, é um processo que envolve simultaneamente a oxidação (perda de elétrons) e a redução (ganho de elétrons). Essas reações são essenciais para uma infinidade de processos, desde a respiração celular que nos mantém vivos até a produção de energia em baterias e a fabricação de diversos materiais. Entender a oxirredução é fundamental para compreender a química em sua essência.
Conceito e Definição de Oxirredução: Oxirredução: O Que É, Como Ocorre, Tipos, Resumo – Brasil Escola

Oxirredução, também conhecida como reação redox, é um tipo fundamental de reação química que envolve a transferência de elétrons entre espécies químicas. Esse processo simultâneo de oxidação e redução é essencial em diversos fenômenos naturais e processos industriais, desde a respiração celular até a produção de metais. Em termos simples, uma reação de oxirredução implica uma mudança no estado de oxidação dos átomos envolvidos.Oxidação e redução são dois processos interdependentes: um não pode ocorrer sem o outro.
A oxidação representa a perda de elétrons por uma espécie química, enquanto a redução representa o ganho de elétrons por outra. Imagine a ferrugem em um prego de ferro: o ferro (Fe) perde elétrons para o oxigênio (O2) do ar, oxidando-se e formando óxido de ferro (ferrugem). Simultâneamente, o oxigênio ganha elétrons, sendo reduzido. Outro exemplo cotidiano é a queima de combustíveis, como a gasolina em um carro.
Os átomos de carbono nos hidrocarbonetos da gasolina perdem elétrons (oxidação), enquanto o oxigênio do ar ganha elétrons (redução), liberando energia na forma de calor.Reações de oxirredução se distinguem de outras reações químicas pela transferência explícita de elétrons. Em reações de ácido-base, por exemplo, há transferência de prótons (íons H+), não de elétrons. Reações de precipitação envolvem a formação de um sólido insolúvel, sem necessariamente implicar transferência de elétrons.
Já nas reações de oxirredução, a mudança no número de oxidação dos átomos participantes é a característica definidora do processo.
Exemplos de Reações de Oxirredução

A tabela abaixo ilustra alguns exemplos de reações de oxirredução, identificando os agentes oxidantes e redutores em cada caso. O agente oxidante é a espécie que recebe elétrons, sofrendo redução, enquanto o agente redutor é a espécie que doa elétrons, sofrendo oxidação.
| Reação | Agente Oxidante | Agente Redutor | Observações |
|---|---|---|---|
| 2Mg(s) + O2(g) → 2MgO(s) | O2 (oxigênio) | Mg (magnésio) | Reação de combustão, altamente exotérmica. |
| Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s) | Cu2+ (íon cobre(II)) | Zn (zinco) | Reação utilizada em pilhas. |
| 2Fe3+(aq) + 2I–(aq) → 2Fe2+(aq) + I2(aq) | Fe3+ (íon ferro(III)) | I– (íon iodeto) | Reação de titulação redox. |
| 2H2(g) + O2(g) → 2H2O(l) | O2 (oxigênio) | H2 (hidrogênio) | Reação de combustão, fundamental para a vida. |
Aplicações da Oxirredução e Importância
A oxirredução, processo fundamental na química, encontra amplas aplicações em diversas áreas, desde a manutenção da vida até processos industriais de grande escala. Sua importância reside na capacidade de transferir elétrons entre espécies químicas, resultando em transformações energéticas e estruturais cruciais para inúmeros sistemas. A compreensão desses processos é vital para o desenvolvimento tecnológico e para a elucidação de mecanismos biológicos complexos.
Oxirredução na Biologia, Oxirredução: O Que É, Como Ocorre, Tipos, Resumo – Brasil Escola

A oxirredução desempenha um papel central em processos biológicos essenciais. A respiração celular, por exemplo, é uma série de reações redox que liberam energia a partir da glicose. Nesse processo, a glicose é oxidada, perdendo elétrons, enquanto o oxigênio é reduzido, ganhando elétrons. Essa transferência de elétrons gera um fluxo de energia que impulsiona a síntese de ATP, a principal molécula de armazenamento de energia nas células.
Outras reações redox importantes na biologia incluem a fotossíntese, onde a energia luminosa é utilizada para reduzir o dióxido de carbono a açúcares, e as reações de redução-oxidação envolvidas na síntese de proteínas e ácidos nucleicos. A oxidação de lipídios e a redução de nitratos também são exemplos relevantes.
Oxirredução na Indústria
A oxirredução é amplamente utilizada em processos industriais, com aplicações que abrangem desde a produção de metais até a síntese de compostos químicos. A metalurgia extractiva, por exemplo, depende fortemente de reações redox para a obtenção de metais a partir de seus minérios. A redução de óxidos metálicos, como o óxido de ferro (Fe2O3) em ferro metálico (Fe), é um exemplo clássico.
Outros processos industriais importantes que se baseiam em reações redox incluem a produção de cloro e soda cáustica (eletrólise da salmoura), a síntese de amônia (processo Haber-Bosch) e a fabricação de baterias. A indústria química utiliza amplamente agentes oxidantes e redutores em diversas sínteses orgânicas e inorgânicas.
Agentes Oxidantes e Redutores Industriais

Diversos agentes oxidantes e redutores são empregados em processos industriais. Entre os oxidantes, destacam-se o permanganato de potássio (KMnO4), o dicromato de potássio (K2Cr2O7), o peróxido de hidrogênio (H2O2) e o ácido nítrico (HNO3). Já entre os redutores, temos o hidrogênio (H2), o monóxido de carbono (CO), o dióxido de enxofre (SO2) e o ácido oxálico (C2H2O4). A escolha do agente redox apropriado depende das características da reação e dos produtos desejados.
A eficiência e a seletividade das reações redox industriais são fatores críticos para a otimização dos processos e a minimização de impactos ambientais.
A oxirredução é fundamental para a vida na Terra, sustentando processos biológicos essenciais como a respiração celular e a fotossíntese. Sem essas reações, a vida como a conhecemos seria impossível. A capacidade de transferir elétrons permite a conversão e o armazenamento de energia, impulsionando o metabolismo e a construção de moléculas complexas.
Em resumo, a oxirredução é um processo químico onipresente e crucial para a vida e a tecnologia. De reações biológicas fundamentais à produção industrial de diversos materiais, a transferência de elétrons molda o mundo ao nosso redor. Compreender os mecanismos e tipos de reações redox abre portas para o desenvolvimento de novas tecnologias e para uma melhor compreensão dos processos naturais que nos cercam.
Esperamos que este texto tenha contribuído para um aprofundamento no conhecimento sobre esse tema tão importante.

